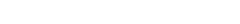
医疗|药品临床试验医疗纠纷处理与合规建议
本文背景
最近代理了一起药品临床试验死亡纠纷案。
我们代理患方(受试者)向药企和医院主张赔偿,先是起诉到法院,最后经各方协商方式结案。
比起处理一般医疗纠纷,药品临床试验医疗纠纷更为复杂,涉及药企、医院、临床试验外包组织(CRO)、保险公司等多重主体责任和法律关系。
本文以临床试验医疗纠纷为视角,为患方、药企、医院、CRO纠纷处理与合规提供实务建议。
本文目录
01.什么是药品临床试验
02.临床试验法律责任主体及关系
03.临床试验医疗损害,患者如何索赔?
04.临床试验出现医疗损害,各方举证责任和抗辩
05.医院临床试验合规建议
06.药企临床试验合规建议
07.CRO临床试验合规建议
01 什么是药品临床试验
临床试验,是药品研发、上市必经之路。
《药品注册管理办法》第二十条规定,药物临床试验为确定药物安全性与有效性在人体开展的药物研究。
《药物临床试验质量管理规范》第十一条规定,临床试验,指以人体(患者或健康受试者)为对象的试验,意在发现或验证某种试验药物的临床医学、药理学以及其他药效学作用、不良反应,或者试验药物的吸收、分布、代谢和排泄,以确定药物的疗效与安全性的系统性试验。
药物临床试验分四期。以药品注册上市为目的的药物临床试验,分为:
Ⅰ期临床试验
Ⅱ期临床试验
Ⅲ期临床试验
Ⅳ期临床试验
药品在上市前要完成Ⅰ、Ⅱ、Ⅲ期,为上市评审提供可靠的数据支撑;第Ⅳ期为药品上市后应用研究,主要考察药物广泛适用后的疗效及风险点。
02 临床试验法律责任主体及关系
参与药物临床试验的法律主体主要有六类:
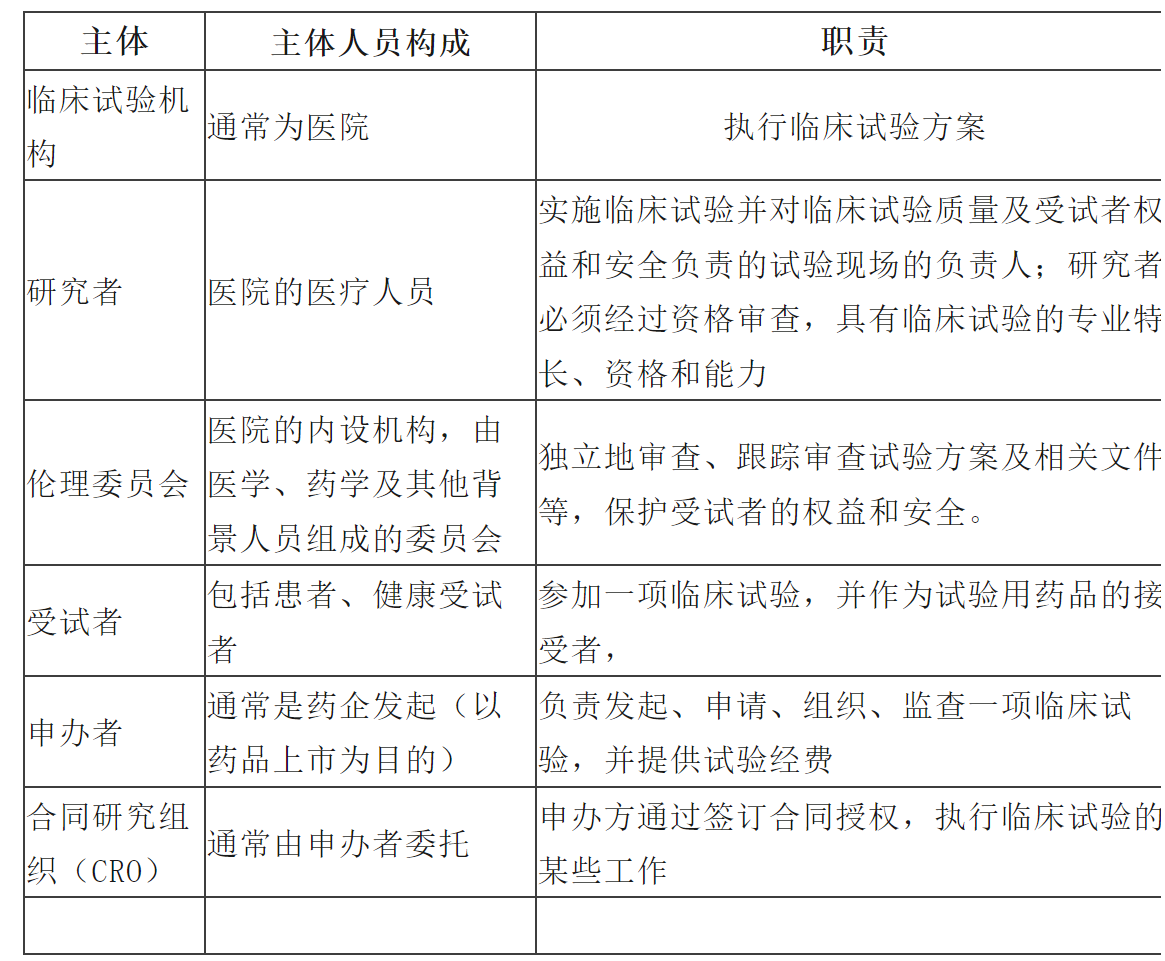
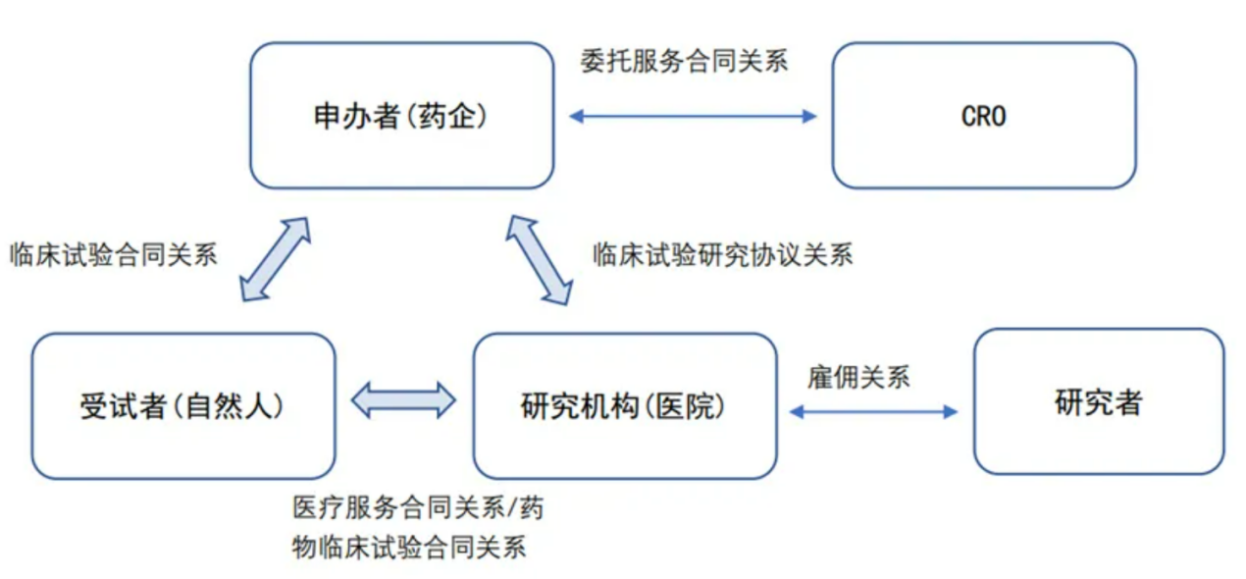
参与药物临床试验的法律主体法律关系如下:
03 受试者,临床试验出现医疗损害,如何索赔?
如果受试者(患者),在临床试验中出现医疗损害或死亡,可以涉及责任的主体包括:医药企业(申办方)、医院(研究者)、保险公司。
方式1:主张侵权责任
在临床试验过程中,患者出现损害或死亡,可以以“医疗损害责任纠纷”或“生命权健康权纠纷”起诉医院或药企。
例如:湖北省武汉市江汉区人民法院(2023)鄂0103民初2938号民事判决书
法院认为:本案为医疗责任纠纷。查明的事实可知,余某在参加案涉药物临床试验前即已为肺癌晚期,即患者余某的生命状况已处于高危状态;案涉药品为合格药品,试验方案经过有关管理部门批准和备案,试验机构被告协和医院是经备案登记有资质的临床试验机构,本案临床试验经过了协和医院伦理委员会审查批准;患者余某自愿参与本次临床试验并在充分知悉试验情况及风险后自愿签署本临床试验的《知情同意书》
方案2:主张违约责任
受试者与医药企业不一定签订合同,但都会有《受试者知情同意书》,会告知临床试验内容、风险、补偿救济等内容。司法实践中会以知情同意书来认定系合同关系。《受试者知情同意书》会体现医院医生(研究者)、医院伦理委员会(伦理审查)、医药企业(申办方)的权利义务。在司法实践中,可一并向医疗机构和药企主张违约责任。
例如:广州市中级人民法院(2023)粤01民终22200号上海某药业有限公司、於某凤等合同纠纷民事二审民事判决书
法院认为:本案中,虽《知情同意书》的直接签订方是某肿瘤中心与患者,但从所载内容可见,明确列明某公司提供药物、提供研究期间治疗需要的各项检查费用、提供保险,某公司作为案涉临床试验的申办方和研究方,为案涉临床试验提供研究药物及资金,临床试验的数据、研究结果也是某公司所有或与研究机构共享,《知情同意书》的相关条款不仅对某肿瘤中心及患者有约束力,对某公司也有约束力,包括若出现损害时,申办方将按照规定提供相应的治疗费用报销及相应的经济赔偿等,足以证实某公司事实上亦系药物临床试验合同权利义务的一方承受者,与患者以事实行为建立合同关系。
方案3:主张公平责任
在司法实践中,即便药企或医院没有过错,从强制规定和公平责任的角度,法院会据此规定判令申办者给受试者的损害承担一定赔偿或补偿责任。主要依据《药物临床试验质量管理规范(2020版)》第三十九条强制的规定:
申办者应当采取适当方式保证可以给予受试者和研究者补偿或者赔偿。
申办者应当提供与临床试验相关的法律上、经济上的保险或者保证,临床试验的风险性质和风险程度相适应。
申办者应当承担受试者与临床试验相关的损害或者死亡的诊疗费用,以及相应的补偿。申办者和研究者应当及时兑付给予受试者的补偿或者赔偿。
方案4:保险责任
旧版《药物临床试验质量管理规范》规定,申办者(药企)应对参加临床试验的受试者提供保险。2020年新修订的《药物临床试验质量管理规范》虽然不再强制要求药企为受试者购买保险,但在39条仍然规定:“申办者应当向研究者和临床试验机构提供与临床试验相关的法律上、经济上的保险或者保证”,故申办人一般仍会继续购买临床试验保险。如果受试者因临床试验受到损害,可向药企或保险主张保险责任。
04 临床试验出现医疗损害,各方举证责任和抗辩
1.受试者(患者)的举证责任
患者如果以侵权纠纷起诉,谁主张谁举证,无论是生命权健康纠纷还是医疗损害责任纠纷,患方要举证证明医疗行为对损害后果存在过错和因果关系,一般通过医疗损害司法鉴定完成举证。
如果患者因合同纠纷起诉,患者要初步证明临床损害结果与临床试验行为或药物关联,即初步证明药企或医院存在违约行为。
2.研究者(医院)的举证责任
医院在临床试验中要对医疗行为负责,医院要证明其医疗行为没有过错。
但患者如以合同纠纷起诉药企,将医院列为共同被告,医院要证明其医疗行为和医疗程序符合规范,没有违反法定或约定。
3.申办方(药企)的举证责任
临床试验中的“药品”属于医疗产品。
根据《最高人民法院关于审理医疗损害责任纠纷案件适用法律若干问题的解释》第七条的规定:
患者应当提交使用医疗产品与损害后果有因果关系的证据,无法提供的,可以申请鉴定。主张不承担责任的,应当对医疗产品不存在缺陷或者血液合格等抗辩事由承担举证证明责任。
因此,受试者要证明损害是临床试验造成的,就推定药企医疗产品存在缺陷,药企要举证证明其没有产品存在缺陷,否则要承担不利后果。司法实践中,产品缺陷包含设计缺陷、生产缺陷、告知缺陷。
05 医院临床试验6点合规建议
如果受试者出现损害,一般通过主张民事赔偿或行政投诉,医疗机构临床试验风险防范的建议:
1.《临床试验知情同意书》充分告知医疗风险。
2.研究医生要及时跟进和了解受试者的病情,不能只依赖外部(CRO)的协调员
3.如果出现病情急速加重或药物不良反应及时停止临床试验用药
4.患者出现损害、死亡的不良事件或严重不良事件要及时向伦理委员会汇报,并向相关部门报告不良事件。
5.注意《临床试验知情同意书》中研究者的责任描述,避免过度承担责任。
6.医院与申办者(药企)签订临床试验协议中要明确申办者临床试验药品安全保障责任、购买保险责任,以便受试者因临床试验药品出现损害,向药企追偿责任。
06 药企临床试验5点合规建议
在临床试验中,如果受试者出现损害或纠纷,药企作为申办者是第一责任人,药企临床试验风险防范的建议:
1.《临床试验知情同意书》要充分告知药物风险与不良反应。
2.药企委托外部的合同研究组织(CRO),要求外部协同人员严格履行跟踪用药责任和义务,出现不良反应或不良事件要第一时间采取措施并与医院和药企报告,并约定违约责任。
3.为受试者购买的保险,注意保险免责条款和理赔的额度和范围。
4.出现不良事件或严重不良事件,根据规定要及时向医院及相关部门报告。
5.药品临床试验如果出现医疗损害或不良事件,最大的风险是不是医疗损害赔偿本身,而是因损害或不良事件延伸的社会事件、行政处罚从而影响药品研发和上市进程。
第一时间积极与受试者协商赔偿或补偿,避免受试者起诉或投诉,影响药物上市进程。
07 CRO临床试验4点合规建议
CRO(合同研究组织)又称“医药研发外包”,CRO公司承接了制药企业的部分药物研发和临床试验项目,其提供的服务可以覆盖从药物发现、临床前研究、临床研究到新药注册申报的整个流程。
临床试验开始后,CRO接受邀请的委托,在临床试验过程中协调跟进医院医生和患者临床试验的进展,包括跟进患者每日用药、检查和不良反应。有些临床试验用药是可以在院外服用的,患者在临床试验过程中出现的任何情况,甚至比医生还早知道。因此我们建议CRO:
1.掌握临床试验药物每个不良反应,患者出现不良反应马上报告。
2.及时在各阶段告知患方药物不良反应类型和症状。
3.患者出现不良反应及时报告医生和相关人员,避免损害扩大。
4.CRO不具有医师资质,避免实行医疗行为,如何用药、用药量,需要医生安排,CRO只是跟进和反馈,不可越权,以免被承担非法行医责任和违约赔偿责任。
首发:微信公众号“律师维钦”


公司决议下次,股东是否打赏的卡死了肯德基阿里
- 情感童声
- 性感男声
- 特别男声
- 普通男声
- 普通女声
- 0.7X
- 1.0X
- 1.5X
- 2X
- 3X
- 4X
- 特大
- 大
- 标准
- 小
作者
- 文章5
- 读者2w
- 关注2
- 点赞17
北京大成(厦门)律师事务所 合伙人
中国研究型医院学会医药法律专业委员会委员
福建省医事法学研究会理事
福建中医药大学校外导师
福建新闻 频道 公益律师
厦门市律师协会医药专业委员会委员
我也要当作者思想共享 知识变现
猜你喜欢
换一换作者推荐
换一换常见问题
-
1、“点读”是什么?
点读是点睛网APP中的一款全民学法的人工智能(AI)新产品。它能“识字”和“朗读”,它使“读屏”变“听书”,解放读者的眼睛和颈椎。它使“讲课”变“写作”,解放讲师的时间和身心。
-
2、“点读”的作者?
在点睛网PC或APP端注册,登录点睛网PC端个人后台,点击“我的文章”,填写作者信息并上传文章。当第一篇文章通过编辑审核后,即成为点睛网的正式作者。
-
3、“点读”的文章?
作者在点睛网个人中心发布文章,编辑审核合格的才能呈现给读者。作者只能发布自己写的文章,不能发布或转发他人的文章。更不能发布有违法律法规、政府规定,或公序良俗、文明风尚、社会和谐等文章。
-
4、“点读”的审核?
作者文章上传后,编辑将在工作日最晚不超过24个小时、非工作日最晚不超过48个小时内完成审核。审核未通过的,说明理由。文章评论的审核,参照以上周期。

















